Toremifene
Toremifene, được bán dưới tên thương hiệu Fareston trong số những người khác, là một loại thuốc được sử dụng trong điều trị ung thư vú tiến triển ở phụ nữ sau mãn kinh.[3][4][5] Nó được dùng bằng đường uống.
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Phát âm | /ˈtɔːrəmɪfiːn/ |
| Tên thương mại | Fareston, others |
| Đồng nghĩa | (Z)-Toremifene; 4-Chlorotamoxifen; Acapodene; CCRIS-8745; FC-1157; FC-1157a; GTx-006; NK-622; NSC-613680 |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a608003 |
| Giấy phép | |
| Dược đồ sử dụng | By mouth |
| Mã ATC | |
| Dữ liệu dược động học | |
| Sinh khả dụng | Good[1] |
| Liên kết protein huyết tương | >99%[1] |
| Chuyển hóa dược phẩm | Gan (CYP3A4)[1][2] |
| Chất chuyển hóa | N-Desmethyltoremifene; 4-Hydroxytoremifene; Ospemifene[3][4] |
| Chu kỳ bán rã sinh học | Toremifene: 5–6 days[1][3] Metabolites: 4–21 days[1][4] |
| Bài tiết | Feces: 70% (as metabolites)[1] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS |
|
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Phối tử ngân hàng dữ liệu protein | |
| ECHA InfoCard | 100.125.139 |
| Dữ liệu hóa lý | |
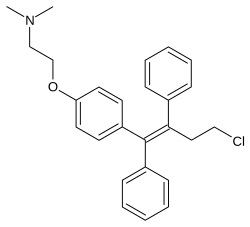
| Công thức hóa học | C26H28ClNO |
| Khối lượng phân tử | 405.959 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Tác dụng phụ của toremifene bao gồm bốc hỏa, đổ mồ hôi, buồn nôn, nôn, chóng mặt, tiết dịch âm đạo và chảy máu âm đạo.[2][6] Nó cũng có thể gây ra cục máu đông, nhịp tim không đều, đục thủy tinh thể, rối loạn thị giác, men gan tăng cao, tăng sản nội mạc tử cung và ung thư nội mạc tử cung. Nồng độ calci trong máu cao có thể xảy ra ở phụ nữ bị di căn xương.
Thuốc là một bộ điều biến thụ thể estrogen chọn lọc (SERM) và do đó là một chất chủ vận - chất đối vận hỗn hợp của thụ thể estrogen (ER), đích sinh học của estrogen như estradiol.[2][6] Nó có tác dụng estrogen trong xương, gan, tử cung và tác dụng chống ung thư ở vú.[5][7][8] Nó là một dẫn xuất triphenylethylene và có liên quan chặt chẽ với tamoxifen.[9]
Toremifene được giới thiệu cho sử dụng y tế vào năm 1997.[10][11] Nó là chất chống ung thư đầu tiên được giới thiệu kể từ tamoxifen vào năm 1978.[12] Nó có sẵn như là một loại thuốc chung ở Hoa Kỳ.[13]
Sử dụng trong y tế
sửaToremifene được phê duyệt để điều trị ung thư vú di căn ở phụ nữ mãn kinh với khối u dương tính với thụ thể estrogen hoặc không rõ tình trạng.[4][5] Đây là sử dụng duy nhất được phê duyệt tại Hoa Kỳ.[4] Nó cho thấy hiệu quả tương đương với tamoxifen cho chỉ định này. Toremifene đã được tìm thấy là có hiệu quả trong điều trị đau vú và có thể là một loại thuốc tốt hơn tamoxifen cho chỉ định này.[14] Toremifene đã được báo cáo để cải thiện đáng kể các triệu chứng của gynecomastia ở nam giới.[15]
Các hình thức có sẵn
sửaToremifene được cung cấp dưới dạng viên nén uống 60 mg.[16][17]
Tác dụng phụ
sửaCác tác dụng phụ của toremifene tương tự như của tamoxifen.[2] Tác dụng phụ phổ biến nhất là bốc hỏa. Các tác dụng phụ khác bao gồm đổ mồ hôi, buồn nôn, nôn, chóng mặt, tiết dịch âm đạo và chảy máu âm đạo.[6] Ở phụ nữ bị di căn xương, tăng calci máu có thể xảy ra. Toremifene có một rủi ro nhỏ về các biến cố huyết khối. Đục thủy tinh thể, thay đổi thị lực và tăng men gan đã được báo cáo. Thuốc kéo dài khoảng QT và do đó có nguy cơ rối loạn nhịp tim có thể gây tử vong. Nguy cơ rối loạn nhịp có thể được giảm bằng cách tránh sử dụng ở những bệnh nhân với hạ kali máu, hypomagnesemia, tồn tại trước đó kéo dài QT, và ở những người dùng thuốc kéo dài QT-khác. Vì toremifene có các hoạt động estrogen trong tử cung, nó có thể làm tăng nguy cơ tăng sản nội mạc tử cung và ung thư nội mạc tử cung.
Tương tác
sửaToremifene là một chất nền của CYP3A4, một cytochrome P450 enzyme, và do đó các loại thuốc gây ra hoặc ức chế enzym này tương ứng có thể làm giảm hoặc mức tăng toremifene trong cơ thể.[2]
Dược lý
sửaDược lực học
sửaToremifene là một ligand cạnh tranh của thụ thể estrogen và đã hòa trộn tác động chủ vận và đối vận trong một phong thái mô-chọn lọc.[6] Nó có hoạt động estrogen trong xương, hoạt động estrogen một phần trong tử cung và gan, và hoạt động chống estrogen tinh khiết ở vú.[2][5][7][8] Thuốc rất giống với tamoxifen và chia sẻ hầu hết các thuộc tính của nó. Có một số dấu hiệu cho thấy nó có thể an toàn hơn tamoxifen vì nó không phải là chất gây ung thư gan ở động vật và có thể ít có khả năng gây nhiễm độc gen.[3] Tuy nhiên, các nghiên cứu lâm sàng đã tìm thấy không có sự khác biệt đáng kể giữa toremifene và tamoxifen, bao gồm cả về hiệu quả, khả năng dung nạp và an toàn, và do đó việc sử dụng toremifene trên lâm sàng đã bị hạn chế phần nào.
Toremifene đã được tìm thấy có tác dụng kháng gonadotropic ở phụ nữ mãn kinh,[18] tác dụng progonadotropic ở nam giới,[19] để tăng mức độ globulin gắn với hormone giới tính, và làm giảm khoảng 20% yếu tố tăng trưởng giống như insulin phụ nữ mãn kinh và nam giới.[20]
Toremifene có khoảng một phần ba tiềm năng của tamoxifen; tức là 60 mg toremifene tương đương với 20 mg tamoxifen trong điều trị ung thư vú.[21]
Dược động học
sửaSinh khả dụng của toremifene chưa được xác định chính xác nhưng được biết là tốt. Thuốc liên kết hơn 99% với protein huyết tương. Nó được chuyển hóa ở gan chủ yếu bởi CYP3A4 và sau đó trải qua quá trình hydroxyl hóa thứ cấp. Các chất chuyển hóa của toremifene bao gồm N-desmethyltoremifene và 4-hydroxytoremifene và ít hoạt động hơn chính toremifene.[22] Ospemifene (deaminohydroxytoremifene) cũng là một chất chuyển hóa chính của toremifene.[4] Toremifene và 4-hydroxytoremifene có thời gian bán hủy rất dài từ 5 đến 6 ngày, trong khi N-desmethyltoremifene có thời gian bán hủy dài hơn từ 6 đến 21 ngày và ospemifene có thời gian bán hủy là 4 ngày. Thời gian bán hủy dài của toremifene và các chất chuyển hóa của nó có thể được quy cho sự tuần hoàn ruột gan.[2] Toremifene được loại bỏ 70% trong phân, dưới dạng các chất chuyển hóa.
Không giống như tamoxifen, toremifene không phải là tiền chất và không phụ thuộc vào quá trình trao đổi chất bởi CYP2D6 cho hoạt tính sinh học; do đó, có thể thích hợp hơn với tamoxifen trong các chất chuyển hóa kém CYP2D6 hoặc ở những bệnh nhân đang dùng thuốc ức chế CYP2D6.[23]
Hóa học
sửaToremifene, còn được gọi là 4-chlorotamoxifen, là một dẫn xuất của triphenylethylene và một chất tương tự mật thiết của tamoxifen.[9] Nó cũng liên quan chặt chẽ với afimoxifene (4-hydroxytamoxifen) và ospemifene (deaminohydroxytoremifene).[23][24]
Lịch sử
sửaToremifene được giới thiệu ở Hoa Kỳ vào năm 1997.[10][11] Nó là chất chống ung thư đầu tiên được giới thiệu ở đất nước này kể từ tamoxifen năm 1978.[12]
Xã hội và văn hoá
sửaTên gốc
sửaToremifene là tên gốc của thuốc và INN và BAN của nó, trong khi toremifene citrate là USAN và JAN và torémifène là DCF của nó.[25][26][27][28]
Tên thương hiệu
sửaToremifene được bán trên thị trường gần như độc quyền dưới tên thương hiệu Fareston.[26][28]
khả dụng
sửaToremifene được bán rộng rãi trên toàn thế giới và có sẵn ở Hoa Kỳ, Vương quốc Anh, Ireland, nhiều nước châu Âu khác, Nam Phi, Úc, New Zealand và các nơi khác trên thế giới.[26][28]
Nghiên cứu
sửaToremifene cũng được đánh giá để ngăn ngừa ung thư tuyến tiền liệt và có thương hiệu dự kiến Acapodene.[29]
Năm 2007, công ty dược phẩm GTx, Inc đã tiến hành hai thử nghiệm lâm sàng giai đoạn 3 khác nhau; Đầu tiên, một thử nghiệm lâm sàng Giai đoạn then chốt để điều trị các tác dụng phụ nghiêm trọng của liệu pháp androgen (ADT) (đặc biệt là gãy đốt sống/cột sống và bốc hỏa, hồ sơ lipid và gynecomastia) đối với ung thư tuyến tiền liệt tiến triển và giai đoạn thứ hai, giai đoạn III thử nghiệm để ngăn ngừa ung thư tuyến tiền liệt ở những người đàn ông có nguy cơ cao mắc u tuyến tiền liệt cao, hoặc PIN. Kết quả của các thử nghiệm này dự kiến vào quý đầu năm 2008 [30]
Một NDA cho ứng dụng đầu tiên (giảm tác dụng phụ ADT của ung thư tuyến tiền liệt) đã được đệ trình vào tháng 2 năm 2009,[31] và vào tháng 10 năm 2009, FDA cho biết họ sẽ cần thêm dữ liệu lâm sàng, ví dụ như một thử nghiệm pha III khác.[32]
Cuối cùng, sự phát triển đã bị ngừng lại và toremifene không bao giờ được bán trên thị trường cho các biến chứng liên quan đến ADT hoặc điều trị hoặc phòng ngừa ung thư tuyến tiền liệt.[33]
Kết quả thử nghiệm giai đoạn III
sửaMột thử nghiệm lâm sàng mù đôi, kiểm soát giả dược, ngẫu nhiên, 3 năm về toremifene đã được tiến hành bằng cách sử dụng mẫu 1.260 nam giới. Đối tượng có độ tuổi trung bình là 64 tuổi và được chẩn đoán mắc u tuyến tiền liệt tuyến tiền liệt cao cấp (HGPIN), được coi là tiền ung thư, mặc dù Thompson và Leach cảm thấy mã PIN cấp thấp cũng có thể được coi là tiền ung thư.[34]
Nhà tài trợ, GTx, người thiết kế và quản lý nghiên cứu, đã tìm thấy 34,7% giả dược và 32,3% nhóm toremifene có các sự kiện ung thư. Không có sự khác biệt được tìm thấy trong thang điểm Glory của một trong hai nhóm.[35]
Các nghiên cứu trên chuột trước đây sử dụng adenocarcinoma biến đổi gen của chuột tuyến tiền liệt chuột (TRAMP) cho thấy toremifene ngăn ngừa khối u sờ thấy ở 60% động vật. Nghiên cứu này đã sử dụng toremifene như một phương pháp dự phòng sớm, khác biệt với nghiên cứu ở giai đoạn III của con người.[36]
Tham khảo
sửa- ^ a b c d e f Vincent T. DeVita Jr.; Theodore S. Lawrence; Steven A. Rosenberg (ngày 7 tháng 1 năm 2015). DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. Wolters Kluwer Health. tr. 1126–. ISBN 978-1-4698-9455-3.
- ^ a b c d e f g Laura Rosenthal; Jacqueline Burchum (ngày 17 tháng 2 năm 2017). Lehne's Pharmacotherapeutics for Advanced Practice Providers - E-Book. Elsevier Health Sciences. tr. 931–. ISBN 978-0-323-44779-9.
- ^ a b c d Bruce A. Chabner; Dan L. Longo (ngày 7 tháng 12 năm 2011). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott Williams & Wilkins. tr. 659–. ISBN 978-1-4511-4820-6.
- ^ a b c d e f https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/020497s006lbl.pdf
- ^ a b c d William R. Miller; James N. Ingle (ngày 8 tháng 3 năm 2002). Endocrine Therapy in Breast Cancer. CRC Press. tr. 55–57. ISBN 978-0-203-90983-6.
- ^ a b c d David Schiff; Isabel Arrillaga; Patrick Y. Wen (ngày 16 tháng 9 năm 2017). Cancer Neurology in Clinical Practice: Neurological Complications of Cancer and its Treatment. Humana Press. tr. 296–. ISBN 978-3-319-57901-6.
- ^ a b Monica Morrow; Virgil Craig Jordan (2003). Managing Breast Cancer Risk. PMPH-USA. tr. 192–. ISBN 978-1-55009-260-8.
- ^ a b Selective Estrogen Receptor Modulators—Advances in Research and Application: 2013 Edition: ScholarlyBrief. ScholarlyEditions. ngày 1 tháng 5 năm 2013. tr. 51–. ISBN 978-1-4901-0447-8.
- ^ a b Antonio Cano; Joacquim Calaf i Alsina; Jose Luis Duenas-Diez (ngày 22 tháng 9 năm 2006). Selective Estrogen Receptor Modulators: A New Brand of Multitarget Drugs. Springer Science & Business Media. tr. 52–. ISBN 978-3-540-34742-2.
- ^ a b Orlando E. Silva; Stefano Zurrida (2005). Breast Cancer: A Practical Guide. Elsevier Health Sciences. tr. 355–. ISBN 0-7020-2744-8.
- ^ a b Wayne R. Bidlack; Stanley T. Omaye; Mark S. Meskin; Debra K.W. Topham (ngày 16 tháng 3 năm 2000). Phytochemicals as Bioactive Agents. CRC Press. tr. 26–. ISBN 978-1-56676-788-0.
- ^ a b Philip J. DiSaia; William T. Creasman; Robert S Mannel; D. Scott McMeekin, David G Mutch (ngày 4 tháng 2 năm 2017). Clinical Gynecologic Oncology E-Book. Elsevier Health Sciences. tr. 124–. ISBN 978-0-323-44316-6.
- ^ “Generic Fareston Availability - Drugs.com”. Drugs.com (bằng tiếng Anh). Truy cập ngày 19 tháng 4 năm 2019.
- ^ Kirby I. Bland; Edward M. Copeland; V. Suzanne Klimberg; William J Gradishar (ngày 29 tháng 6 năm 2017). The Breast E-Book: Comprehensive Management of Benign and Malignant Diseases. Elsevier Health Sciences. tr. 86–. ISBN 978-0-323-51187-2.
- ^ Tabbal, Mahmoud; Fuleihan, Ghada El-Hajj (2010). “Future Therapies”: 713–732. doi:10.1016/B978-0-12-374602-3.00057-2. Chú thích journal cần
|journal=(trợ giúp) - ^ Mari J. Wirfs, PhD, MN, APRN, ANP-BC, FNP-BC, CNE (ngày 9 tháng 5 năm 2019). The APRN and PA’s Complete Guide to Prescribing Drug Therapy 2020. Springer Publishing Company. tr. 60–. ISBN 978-0-8261-7934-0.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Casciato; Mary C. Territo (2012). Manual of Clinical Oncology. Lippincott Williams & Wilkins. tr. 122–. ISBN 978-1-4511-1560-4.
- ^ Ellmén J, Hakulinen P, Partanen A, Hayes DF (tháng 11 năm 2003). “Estrogenic effects of toremifene and tamoxifen in postmenopausal breast cancer patients”. Breast Cancer Res. Treat. 82 (2): 103–11. doi:10.1023/B:BREA.0000003957.54851.11. PMID 14692654.
- ^ Tsourdi E, Kourtis A, Farmakiotis D, Katsikis I, Salmas M, Panidis D (tháng 4 năm 2009). “The effect of selective estrogen receptor modulator administration on the hypothalamic-pituitary-testicular axis in men with idiopathic oligozoospermia”. Fertil. Steril. 91 (4 Suppl): 1427–30. doi:10.1016/j.fertnstert.2008.06.002. PMID 18692782.
- ^ Roelfsema F, Yang RJ, Takahashi PY, Erickson D, Bowers CY, Veldhuis JD (tháng 2 năm 2018). “Effects of Toremifene, a Selective Estrogen Receptor Modulator, on Spontaneous and Stimulated GH Secretion, IGF-I, and IGF-Binding Proteins in Healthy Elderly Subjects”. J Endocr Soc. 2 (2): 154–165. doi:10.1210/js.2017-00457. PMC 5789038. PMID 29383334.
- ^ MacGregor JI, Jordan VC (tháng 6 năm 1998). “Basic guide to the mechanisms of antiestrogen action”. Pharmacol. Rev. 50 (2): 151–96. PMID 9647865.
- ^ George M. Brenner; Craig Stevens (ngày 28 tháng 9 năm 2017). Brenner and Stevens’ Pharmacology E-Book. Elsevier Health Sciences. tr. 394–. ISBN 978-0-323-39172-6.
- ^ a b Georg F. Weber (ngày 22 tháng 7 năm 2015). Molecular Therapies of Cancer. Springer. tr. 304–. ISBN 978-3-319-13278-5.
- ^ Philipp Y. Maximov; Russell E. McDaniel; V. Craig Jordan (ngày 23 tháng 7 năm 2013). Tamoxifen: Pioneering Medicine in Breast Cancer. Springer Science & Business Media. tr. 170–. ISBN 978-3-0348-0664-0.
- ^ J. Elks (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 1222–. ISBN 978-1-4757-2085-3.
- ^ a b c Index Nominum 2000: International Drug Directory. Taylor & Francis. 2000. tr. 1048–. ISBN 978-3-88763-075-1.
- ^ I.K. Morton; Judith M. Hall (ngày 6 tháng 12 năm 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. tr. 277–. ISBN 978-94-011-4439-1.
- ^ a b c “Toremifene - Drugs.com”. Drugs.com (bằng tiếng Anh). Truy cập ngày 8 tháng 2 năm 2018.
- ^ Price N, Sartor O, Hutson T, Mariani S. Role of 5a-reductase inhibitors and selective estrogen receptor modulators as potential chemopreventive agents for prostate cancer. Clin Prostate Cancer 2005;3:211-4. PMID 15882476
- ^ “GTx's Phase III Clinical Development of ACAPODENE on Course Following Planned Safety Review” (Thông cáo báo chí). GTx Inc. ngày 12 tháng 7 năm 2007. Truy cập ngày 14 tháng 7 năm 2006.[liên kết hỏng]
- ^ “GTx Announces Toremifene 80 mg NDA Accepted for Review by FDA” (Thông cáo báo chí).[liên kết hỏng]
- ^ “GTx and Ipsen End Prostate Cancer Collaboration due to Costs of FDA-Requested Phase III Study”. 2 tháng 3 năm 2011.
- ^ “Toremifene - AdisInsight”. adisinsight.springer.com (bằng tiếng Anh). Truy cập ngày 8 tháng 2 năm 2018.
- ^ Thompson Jr, I. M., and Leach, R., Prostate cancer and prostatic intraepithelial neoplasia: true, true, and unrelated? J Clin Oncol, 2013;31:515-6. https://ascopubs.org/doi/full/10.1200/JCO.2012.46.6151=[liên kết hỏng] Retrieved ngày 31 tháng 7 năm 2019
- ^ Taneja, S. S., Morton, R., Barnette, G., Sieber, P., Hancock, M. L., and Steiner, M., Prostate cancer diagnosis among men with isolated high-grade intraepithelial neoplasia enrolled onto a 3-year prospective phase III clinical trial of oral toremifene J Clin Oncol, 2013;31:523-9. https://ascopubs.org/doi/abs/10.1200/JCO.2012.41.7634=[liên kết hỏng] Retrieved ngày 31 tháng 7 năm 2019
- ^ Raghow, S., Hooshdaran, M. Z., Katiyar, S., and Steiner, M. S., Toremifene prevents prostate cancer in the transgenic adenocarcinoma of mouse prostate model. Cancer Research 2002;62:1370-6. http://cancerres.aacrjournals.org/content/62/5/1370= Lưu trữ 2022-02-17 tại Wayback Machine Retrieved ngày 31 tháng 7 năm 2019
Đọc thêm
sửa- Taras TL, Wurz GT, Linares GR, DeGregorio MW (2000). “Clinical pharmacokinetics of toremifene”. Clin Pharmacokinet. 39 (5): 327–34. doi:10.2165/00003088-200039050-00002. PMID 11108432.
- Harvey HA, Kimura M, Hajba A (2006). “Toremifene: an evaluation of its safety profile”. Breast. 15 (2): 142–57. doi:10.1016/j.breast.2005.09.007. PMID 16289904.
- Taneja SS, Smith MR, Dalton JT, Raghow S, Barnette G, Steiner M, Veverka KA (2006). “Toremifene--a promising therapy for the prevention of prostate cancer and complications of androgen deprivation therapy”. Expert Opin Investig Drugs. 15 (3): 293–305. doi:10.1517/13543784.15.3.293. PMID 16503765.
- Zhou WB, Ding Q, Chen L, Liu XA, Wang S (2011). “Toremifene is an effective and safe alternative to tamoxifen in adjuvant endocrine therapy for breast cancer: results of four randomized trials”. Breast Cancer Res. Treat. 128 (3): 625–31. doi:10.1007/s10549-011-1556-5. PMID 21553116.
- Gennari L, Merlotti D, Stolakis K, Nuti R (2012). “Pharmacokinetic evaluation of toremifene and its clinical implications for the treatment of osteoporosis”. Expert Opin Drug Metab Toxicol. 8 (4): 505–13. doi:10.1517/17425255.2012.665873. PMID 22356442.
- Mao C, Yang ZY, He BF, Liu S, Zhou JH, Luo RC, Chen Q, Tang JL (2012). “Toremifene versus tamoxifen for advanced breast cancer”. Cochrane Database Syst Rev (7): CD008926. doi:10.1002/14651858.CD008926.pub2. PMID 22786516.
- Vogel CL, Johnston MA, Capers C, Braccia D (2014). “Toremifene for breast cancer: a review of 20 years of data”. Clin. Breast Cancer. 14 (1): 1–9. doi:10.1016/j.clbc.2013.10.014. PMID 24439786.
- Mustonen MV, Pyrhönen S, Kellokumpu-Lehtinen PL (2014). “Toremifene in the treatment of breast cancer”. World J Clin Oncol. 5 (3): 393–405. doi:10.5306/wjco.v5.i3.393. PMC 4127610. PMID 25114854.