Oxy difluoride
(Đổi hướng từ Oxygen difluoride)
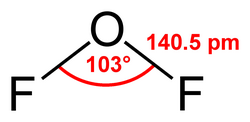
Oxy difluoride là một hợp chất vô cơ có công thức hóa học OF2, là một chất khí không màu có mùi gần giống với ozon, rất độc. OF2 có hình dạng phân tử như nước (hình chữ V), là một chất có tính oxy hóa mạnh. Mặc dầu nó là nguyên tố có chứa oxy và nguyên tố khác (fluor), nhưng không được coi là một oxide, vì độ âm điện của fluor lớn hơn độ âm điện của oxy, số oxy hoá của oxy trong trường hợp này là +2 thay vì -2 trong các oxide.[2]
| Oxy difluoride | |
|---|---|
 Mô hình 2D | |
 Mô hình 3D | |
| Tên khác | Monoxy difluoride hypofluorơ anhydride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| ChEBI | |
| Số RTECS | RS2100000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | OF2 |
| Khối lượng mol | 53,9962 g/mol |
| Bề ngoài | khí không màu, chất lỏng vàng nhạt khi làm lạnh |
| Mùi | hôi |
| Khối lượng riêng | 1,9 g/cm³ (-224 ℃, chất lỏng) 1,719 g/cm³ (-183 ℃, chất lỏng) 1,521 g/cm³ (-145 ℃, chất lỏng) 1,88 g/L (chất khí) |
| Điểm nóng chảy | −223,8 °C (49,3 K; −370,8 °F) |
| Điểm sôi | −144,75 °C (128,40 K; −228,55 °F) |
| Độ hòa tan trong nước | thủy phân[1] |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | 24,5 kJ mol-1 |
| Entropy mol tiêu chuẩn S | 246,98 J/mol K |
| Nhiệt dung | 43,3 J/mol K |
| Các hợp chất liên quan | |
| Hợp chất liên quan | HFO O2F2 NHF2 NF3 SCl2 |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. |
Lịch sử
sửaOxy difluoride được phát hiện lần đầu tiên vào năm 1929 bằng cách cho fluor phản ứng với NaOH loãng 2% lạnh:
Tính chất hóa học
sửaOxy difluoride là một chất khí có tính oxy hóa mạnh. Trên 200 °C (392 °F; 473 K), OF2 bị phân hủy thành O2 và F2:
- 2OF2 → O2↑ + 2F2↑
Phản ứng với nước
sửa- Oxy difluoride phản ứng rất chậm với nước tạo thành acid hydrofluoric:
- OF2 + H2O (l) → 2HF (dd) + O2↑
- Oxy difluoride còn phản ứng với hơi nước ở 250 °C (482 °F; 523 K) tạo thành oxy và hydro fluoride:
- OF2 + H2O (h) → O2 + 2HF
Phản ứng với kim loại và phi kim
sửa- OF2 phản ứng với nhiều kim loại và phi kim tạo thành oxide và fluoride:
- OF2 còn phản ứng với khí trơ, như xenon ở nhiệt độ cao cho XeF4.
Phản ứng với hợp chất
sửa- Oxy difluoride oxy hóa lưu huỳnh dioxide thành lưu huỳnh trioxide và fluor:
- OF2 + SO2 → SO3 + F2↑
- Ngoài ra dưới tác động của tia cực tím UV OF2 còn phản ứng với SO2 tạo thành SO2F2 và S2O5F2:
- SO2 + F2 → SO2F2
- OF2 + 2SO2 → S2O5F2
An toàn
sửaOF2 là một chất độc, cần phải cẩn thận khi tiếp xúc với nó.
Tham khảo
sửa- ^ http://www.chemyq.com/En/xz/xz1/2818mqnrv.htm
- ^ Doubtnut. “OF_(2) should be called oxygen difluolide and not fluorine oxide -”. doubtnut (bằng tiếng Anh). Truy cập ngày 27 tháng 2 năm 2022.