Acid chloric
Acid chloric có công thức là HClO3, là một acid có oxy của chlor. Là acid là một trong những acid mạnh (pKa ≈ −2.7), chỉ tồn tại ở dạng dung dịch. Acid chloric có tính oxy hóa mạnh; tác dụng với lưu huỳnh, phosphor, arsenic, khí lưu huỳnh dioxide. Giấy, bông bốc cháy ngay khi tiếp xúc với dung dịch HClO3 40%. Trong nước, nó mạnh tương đương với acid hydrochloric. Muối quan trọng nhất của nó là kali chlorat (KClO3). Acid chloric rất độc.
| Acid chloric | |
|---|---|
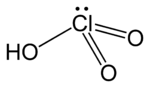 Acid chloric acid | |
 Chloric acid | |
| Tên khác | Chloric(V) acid |
| Nhận dạng | |
| Số CAS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | HClO3 |
| Khối lượng mol | 84.45914 g mol−1 |
| Bề ngoài | Dung dịch không màu |
| Khối lượng riêng | 1 g/mL, solution (approxymate) |
| Điểm nóng chảy | |
| Điểm sôi | |
| Độ hòa tan trong nước | >40 g/100 ml (20 °C) |
| Độ axit (pKa) | ca. −1 |
| Cấu trúc | |
| Hình dạng phân tử | pyramidal |
| Các nguy hiểm | |
| Nguy hiểm chính | Oxidant, Corrosive |
| Các hợp chất liên quan | |
| Anion khác | acid hydrobromic acid hydroiodic |
| Cation khác | Amoni chlorat Natri chlorat Kali chlorat |
| Hợp chất liên quan | Acid hydrochloric Acid hypochlorơ Acid chlorơ Acid pechloric |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Tính chất
sửaAxit cloric không ổn định về mặt nhiệt động theo hướng không cân đối.
Axit cloric ổn định trong dung dịch nước lạnh có nồng độ lên tới khoảng 30% và có thể điều chế các dung dịch có nồng độ lên tới 40% bằng cách làm bay hơi cẩn thận dưới áp suất giảm. Trên nồng độ này, dung dịch axit cloric bị phân hủy tạo ra nhiều loại sản phẩm, ví dụ:
8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
3 HClO3 → HClO4 + H2O + 2 ClO2
Tính chất hoá học
sửaAcid chloric có thể phản ứng với nhiều kim loại trước dãy điện hoá của hydro:
- 2HClO3 + 2K → 2KClO3 + H2
- 2HClO3 + Ca → Ca(ClO3)2 + H2
- 6HClO3 + 2Al → 2Al(ClO3)3 + 3H2
Điều chế
sửaAcid chloric có thể được điều chế bằng phản ứng giữa bari chlorat và acid sunfuric:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4↓
Một phương pháp khác là đun nóng axit hypoclorơ, tạo ra axit cloric và hydro clorua:
3 HClO → HClO3 + 2 HCl
Nguy hiểm
sửaAxit cloric là một tác nhân oxy hóa mạnh mẽ. Hầu hết các chất hữu cơ và chất dễ cháy sẽ bốc cháy khi tiếp xúc.
Tham khảo
sửa- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản thứ 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- R. Bruce King biên tập (1994). “Chloric acid”. encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. tr. 658. ISBN 0-471-93620-0.